UNIST 권태혁·민두영 교수팀, 빛 받아 세포 리소좀 공격하는 화합물 개발
약물 내성 원인 자가포식 억제·동물모델 효과 입증.. Adv.Sci. 논문 게재
 (좌측 하단부터 반시계방향) 권태혁 교수, 박민규 연구원, 민두영 교수, 김서윤 연구원, 양지현 연구원(오투메디), 윤광수 연구원, 이유진 연구원. UNIST 제공
(좌측 하단부터 반시계방향) 권태혁 교수, 박민규 연구원, 민두영 교수, 김서윤 연구원, 양지현 연구원(오투메디), 윤광수 연구원, 이유진 연구원. UNIST 제공
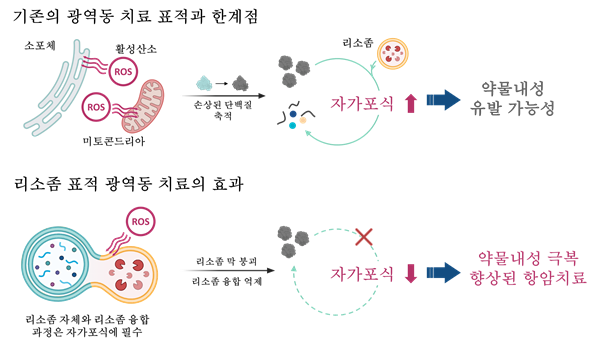 그림. 개발된 리소좀 표적 광감각제 기반 치료의 차별점. 세포 내 산화는 그 위치에 따라 영향이 달라질 수 있음. 기존 광역동 치료 표적의 경우 자가포식을 촉발하는 신호를 일으키는 경우가 많아 약물내성을 극복하는데 불리하였음. 이번 연구에서는 자가포식의 핵심 축인 리소좀을 공략하여 약물내성을 극복하고 암 치료 전략의 개선을 이루어낼 수 있음. UNIST 제공
그림. 개발된 리소좀 표적 광감각제 기반 치료의 차별점. 세포 내 산화는 그 위치에 따라 영향이 달라질 수 있음. 기존 광역동 치료 표적의 경우 자가포식을 촉발하는 신호를 일으키는 경우가 많아 약물내성을 극복하는데 불리하였음. 이번 연구에서는 자가포식의 핵심 축인 리소좀을 공략하여 약물내성을 극복하고 암 치료 전략의 개선을 이루어낼 수 있음. UNIST 제공
항암제 내성이 있는 암세포를 빛을 쪼여 제거하는 기술이 나왔다.
울산과학기술원(UNIST) 화학과 권태혁·민두영 교수팀은 포스텍(POSTECH) 박태호 교수팀과 공동연구를 통해 항암제 내성 원인으로 알려진 암세포의 자가포식을 억제할 수 있는 광 반응 화합물을 개발했다고 16일 밝혔다.
빛을 받으면 활성화되는 이 화합물이 자가포식이 일어나는 공간인 세포 리소좀만을 선택해 공격하는 원리다.
암세포의 변화무쌍한 적응력은 항암제 개발의 주요 장애물로 꼽혀 왔다. 세포 안에 생긴 노폐물을 분해하는 자가포식도 그 적응 기전중 하나다. 암세포는 자가포식을 통해 항암제를 배출하고, 분해된 노폐물 성분으로 부족한 에너지원을 메우며, 면역 체계를 회피하는 것으로 알려져 있다.
연구팀은 이러한 자가포식을 억제하기 위해 모폴린과 이리듐으로 구성된 광 반응 화합물을 개발했다. 모폴린은 세포의 리소좀만을 표적하는 역할을 하며, 이리듐은 빛을 받아 산화 손상을 일으킨다.
개발된 광반응 화합물을 약물내성 췌장암세포가 이식된 쥐에게 투입한 뒤 적외선을 쪼였을 때, 젬시타빈 항암제 내성이 생긴 췌장암 조직이더라도 7일 만에 암이 줄어들며 완전히 사라졌다.
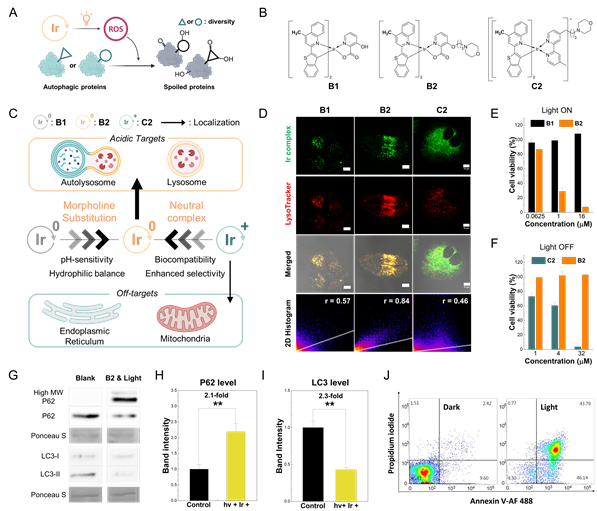 그림. 리소좀 표적 광감각제의 생체적합성 및 광유도 자가포식 억제. A) B2가 공간적·시간적 활성산소 생성을 통해 자가포식을 억제하는 과정. 활성산소는 다양한 구조나 돌연변이를 가진 단백질을 불안정화시킬 수 있다. B) B1, B2, C2의 화학적 구조를 제시하여, B2가 가진 모폴린 치환 특성을 강조하였다. C) 중성 Ir(III) 복합체인 B2의 리소좀 특이성과 생체 적합성 메커니즘의 요약. D) 공초점 현미경과 2D 히스토그램 분석을 통해 B1, B2, C2의 세포 내 분포를 비교하여 B2의 리소좀 표적을 확인했다. E, F) MTT 분석을 통해 Ir(III) 복합체의 세포 독성을 평가하였으며, B2의 광독성과 생체 적합성을 B1 및 C2와 비교하였다. G–I) B2에 의한 광활성화 자가포식 억제는 P62와 LC3 단백질 발현 수준을 기반으로 확인되었다. UNIST 제공
그림. 리소좀 표적 광감각제의 생체적합성 및 광유도 자가포식 억제. A) B2가 공간적·시간적 활성산소 생성을 통해 자가포식을 억제하는 과정. 활성산소는 다양한 구조나 돌연변이를 가진 단백질을 불안정화시킬 수 있다. B) B1, B2, C2의 화학적 구조를 제시하여, B2가 가진 모폴린 치환 특성을 강조하였다. C) 중성 Ir(III) 복합체인 B2의 리소좀 특이성과 생체 적합성 메커니즘의 요약. D) 공초점 현미경과 2D 히스토그램 분석을 통해 B1, B2, C2의 세포 내 분포를 비교하여 B2의 리소좀 표적을 확인했다. E, F) MTT 분석을 통해 Ir(III) 복합체의 세포 독성을 평가하였으며, B2의 광독성과 생체 적합성을 B1 및 C2와 비교하였다. G–I) B2에 의한 광활성화 자가포식 억제는 P62와 LC3 단백질 발현 수준을 기반으로 확인되었다. UNIST 제공
분석결과, 이 광반응 화합물은 빛을 받아 리소좀 막을 파괴함과 동시에 리소좀이 자가포식소체(autophagosome)와 융합되는 것을 방해하는 것으로 나타났다. 자가포식소체는 세포 노폐물이 일시적으로 격리되는 장소로, 자가포식소체와 리소좀 간의 융합이 일어나야 자가포식이 시작된다. 연구팀은 개발된 화합물이 산화손상을 일으키는 단백질들을 추가로 밝혀낼 계획이라고 설명했다.
이번 연구에는 화학과 박민규 연구원이 제1자로 참여했으며, (주)오투메디가 동물실험 모델에서 독성평가와 항암효과 평가를 함께 진행했다.
권태혁 교수는 “자가포식으로 약물내성이 생긴 주요 난치암 치료에 도움이 될 것” 이라며 “젬시타빈 이외에도 기존 항암제들과 병용 치료 효능을 검증하고 있다”고 밝혔다.
이번 연구결과는 국제학술지인 ‘어드밴스드 사이언스(Advanced Science)’에 지난 13일자로 출판됐다. 연구수행은 한국연구재단, 국립암센터, 중소기업정보진흥원, 연구개발특구진흥재단, 울산과학기술원의 지원으로 이루어졌다.
송현수 기자 songh@busan.com













